Novel Food VO (EG) 258/97
Verordnung (EG) Nr. 258/97 - Novel Food Verordnung
Verordnung (EG) Nr. 258/97
Die ► Verordnung (EG) Nr. 258/97
wird auch allgemein als Novel Food Verordnung (Novel Food VO) bezeichnet. Sie spielt in Sachen „Gentechnik und Lebensmittel“ heute keine Rolle mehr, sie wurde durch die Verordnungen (EG) Nr. 1829/2003 und Nr. 1830/2003 abgelöst. Sie wird hier mehr aus historischen Gründen aufgelistet, um die Entwicklungen zur Sicherheitsbewertung, Zulassung, Inverkehrbringen und Kennzeichnung aufzuzeigen.
Am 14. 2. 1997 wurde die Verordnung (EG) Nr. 258/97 des Europäischen Parlaments und des Rates über neuartige Lebensmittel und Lebensmittelzutaten im Amtsblatt veröffentlicht. Die Verordnung trat innerhalb von 90 Tagen, d.h. am 15. Mai 1997, in Kraft. Mit der Novel Food VO wurde die freie Verkehrsfähigkeit von Erzeugnissen und die Eigenverantwortung der Lebensmittelhersteller teilweise eingeschränkt. Dies bedeutete für neuartige Lebensmittel eine Ablösung des Missbrauchsprinzips durch ein Verbotsprinzip. Neuartige Lebensmittel unterliegen im EU-Raum einem einheitlichen Verfahren zum Inverkehrbringen und einer einheitlichen Kennzeichnung
Einzelstaatliche Regelungen für das Inverkehrbringen von gentechnisch modifizierten Lebensmitteln dürfen nicht mehr angewandt werden.
Die Novel Food VO regelt das Inverkehrbringen und die Etikettierung neuartiger Lebens- und Lebensmittelzutaten, darunter von Mai 1997 bis April 2004 auch GVO und daraus hergestellte Erzeugnisse.
Die Novel Food VO umfasst 15 Artikel und kann in die Bereiche
• der Anwendung,
• des Inverkehrbringens und
• der Etikettierung
unterteilt werden.
Anwendungsbereich
Lebensmittel und Lebensmittelzutaten, die unter den Anwendungsbereich der Novel Verordnung fallen, müssen zwei Kriterien erfüllen: Sie dürfen vor in Krafttreten der Novel Food VO im EU-Raum noch nicht im nennenswertem Umfang für den menschlichen Verzehr verwendet worden sein und müssen unter eine von sechs definierten Gruppen von Erzeugnissen fallen (Art. 2).
Es sind Erzeugnisse,
a) die lebende gentechnisch veränderte Organismen im Sinne der Richtlinie 90/220/EWG enthalten oder aus solchen bestehen;
b) die aus gentechnisch veränderten Organismen gewonnen werden, jedoch diese nicht mehr enthalten;
c) die neue oder gezielt veränderte primäre Molekülstrukturen aufweisen;
d) die aus Mikroorganismen, Pilzen oder Algen bestehen oder aus diesen isoliert worden sind;
e) die aus Pflanzen bestehen oder isoliert worden sind, und aus Tieren isolierte Lebensmittelzutaten, außer solchen, die mit
herkömmlichen Vermehrungs- oder Zuchtmethoden gewonnen wurden und die erfahrungsgemäß als unbedenklich gelten
können;
f) bei deren Herstellung ein nicht übliches Verfahren angewandt worden ist und bei denen dieses Verfahren eine bedeutende
Veränderung in ihrer Zusammensetzung oder Struktur bewirkt hat, die sich auf ihren Nährwert, ihren Stoffwechsel oder auf
die Menge an unerwünschter Stoffen im Lebensmittel auswirkt.
Ursprünglich sollte die Novel Food VO lediglich die Gruppen a, b, c und f erfassen.
Nicht unter die Novel Food VO fielen Zusatzstoffe (RL 89/107/EWG), Aromen zur Verwendung in Lebensmitteln (RL 88/388/EWG) sowie Extraktionslösungsmittel zur Herstellung / Verarbeitung von Lebensmitteln (RL 88/344/ EWG).
Beispiele von neuartigen Lebensmitteln
Inverkehrbringen
Neuartige Lebensmittel und Lebensmittelzutaten dürfen nur dann in Verkehr gebracht werden, wenn sie
• keine Gefahr für den Verbraucher darstellen,
• keine Täuschung des Verbrauchers bewirken, und
• sich von traditionellen Produkten, die sie ersetzen sollen, nicht so unterscheiden, dass ihr normaler Verzehr
Ernährungsmängel für den Verbraucher mit sich brächte. (Art. 3)
Die Novel Food VO unterscheidet für das Inverkehrbringen, entsprechend der Verhältnismäßigkeit und möglicher Gefährdungspotentiale, zwischen einem Anmelde- und Zulassungsverfahren (Notifizierung und Genehmigung).
Anmeldeverfahren
Das Anmeldeverfahren (Notifizierung) ist für Erzeugnisse vorgesehen, die in ihrer Zusammensetzung, ihrem Nährwert, Stoffwechsel, Verwendungszweck und Gehalt an unerwünschten Stoffen im Wesentlichen gleichwertig zu traditionellen Produkten sind (Art. 4). Diese Gleichwertigkeit ist durch analytische / wissenschaftliche Daten und ernährungsphysiologische Experimente zu belegen bzw. durch eine vom Mitgliedsstaat beauftragte zuständige Lebensmittelprüfstelle zu verifizieren. Der Antragsteller unterrichtet die Kommission von dem beabsichtigten Inverkehrbringen des Produktes und stellt der Kommission die Unterlagen zum Nachweis der Gleichwertigkeit zur Verfügung. Innerhalb von 60 Tagen unterrichtet die Kommission mit einer Kopie des Antrags die Mitgliedsstaaten. Erhält der Inverkehrbringer keinen ablehnenden Bescheid, so ist das Erzeugnis frei verkehrsfähig. Bei Zweifeln an der Gleichwertigkeit kann der Ständige Lebensmittelausschuss angerufen werden (Art. 13). Die Anmeldungen werden jährlich im Amtsblatt veröffentlicht (Art. 5).
Zulassungsverfahren
Ein Zulassungsverfahren (Genehmigung) ist immer für Erzeugnisse durchzuführen, die
- aus vermehrungsfähigen, gentechnisch veränderten Organismen (GVO) bestehen oder diese enthalten (Gruppe 2a),
- neue oder gezielt geänderte primäre Strukturen aufweisen (Gruppe 2c),
- mit neuen technischen Verfahren hergestellt worden sind (Gruppe 2f).
Darüber hinaus kann ein Genehmigungsverfahren eingeleitet werden, wenn einer der Mitgliedsstaaten oder die Kommission aufgrund wissenschaftlicher Erkenntnisse Vorbehalte gegen das zu notifizierende neuartige Lebensmittel äußern.
Das Unternehmen (der Erstinverkehrbringer) stellt den Antrag auf Genehmigung bei einer zuständigen nationalen Prüfbehörde eines Mitgliedsstaates, in den es (er) das Inverkehrbringen des neuartigen Produktes erstmals beabsichtigt. Der Antrag muss alle Daten enthalten, die belegen, dass das Lebensmittel, die Zutat den Anforderungen aus Artikel 3 entspricht; ein Vorschlag zur Aufmachung und Etikettierung muss ebenfalls beigefügt sein. Der Antragsteller hat der Kommission eine Kopie des Antrags zuzustellen, die ihrerseits die anderen EU-Mitgliedsstaaten unterrichtet. Die nationale Behörde überprüft die Unterlagen auf Vollständigkeit und bewertet die Daten. Sie stellt fest, ob das Verfahren weitergeführt werden kann oder zusätzliche Sicherheitsprüfungen erforderlich sind. Innerhalb von 90 Tagen nach Eingang des vollständigen Antrags muss die nationale Behörde einen Erstprüfbericht anfertigen, den der Mitgliedsstaat an die Kommission weiterleitet. Diese setzt alle weiteren EU-Mitgliedsstaaten von dem Prüfbericht in Kenntnis. Äußern innerhalb von 60 Tagen die Mitgliedsstaaten oder die Kommission keine Einwände gegen das Inverkehrbringen und sind keine weiteren Prüfungen mehr erforderlich, wird das Unternehmen (der Erstinverkehrbringer) vom zuständigen Mitgliedsstaat unterrichtet, dass es (er) das Lebensmittel in Verkehr bringen darf.
Für Lebensmittel und Zutaten, die aus GVO bestehen oder GVO enthalten, wird ein erweitertes Verfahren durchgeführt. Vorzulegen sind
die Kopie der Freisetzungsgenehmigung nach RL 90/220/EWG der zuständigen Behörde,
die Ergebnisse der Sicherheitsprüfungen für Mensch und Umwelt nach Freisetzung,
die Ergebnisse der Umweltverträglichkeitsprüfung entsprechend Art. 11 der RL 90/220/EWG
die Vorlage der Genehmigung zum Inverkehrbringen nach RL 90/220/EWG.
Etikettierung
In Artikel 8 sind die speziellen Etikettierungsanforderungen zur Unterrichtung von Verbrauchern festgelegt. Sie gelten natürlich für alle neuartigen Lebensmittel und-zutaten; sie sind nicht speziell auf gv-Erzeugnisse ausgerichtet.
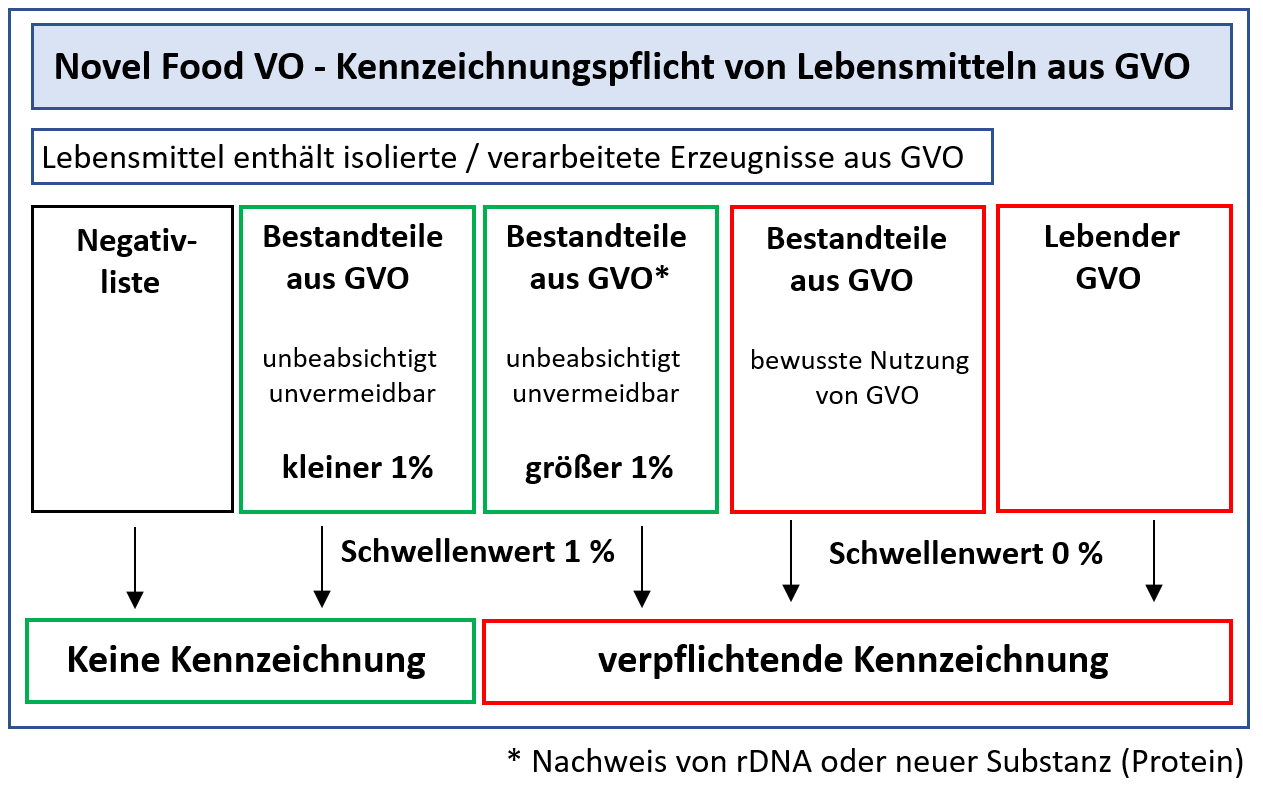
Grundsätzlich müssen alle Lebensmittel und Lebensmittelzutaten gekennzeichnet werden, die lebende GVO sind oder solche enthalten. Die ursprünglich vorgesehene Ausnahmeregelung für agronomische Merkmale wurde gestrichen. Somit müssen insektenresistenter Mais oder herbizidtolerante Sojabohnen als GVO kenntlich gemacht werden, wenn sie auf den Gemeinsamen Europäischen Markt kommen. Ebenso müssen Verbraucher durch eine entsprechende Kennzeichnung informiert werden, wenn das neuartige Erzeugnis im Vergleich zum traditionellen Lebensmittel Stoffe enthält, die die Gesundheit bestimmter Bevölkerungsgruppen beeinflussen können (z.B. neues oder erhöhtes allergenes Potential), oder die zu ethischen, religösen oder diätetischen Bedenken Anlass geben. Dies könnte z. B. das Vorhandensein eines tierischen Gens (Proteins) in traditionell vegetarischen Produkten oder eines „Schweine-Gens“ in Lebensmitteln für Moslems der Fall sein.
Ebenso sind solche Lebensmittel und -zutaten zu kennzeichnen, die sich von vergleichbaren traditionellen Lebensmitteln unterscheiden, d. h. diesen nicht gleichwertig sind (Artikel 8, Absatz 1a).
Entscheidend für die Kennzeichnung ist die Nichtgleichwertigkeit, der nachweisbare Unterschied im Lebensmittel bzw. in der Zutat. Für gentechnisch modifizierte Erzeugnisse bedeutet dies, dass der Unterschied ursächlich auf der gentechnischen Veränderung beruhen muss.
Keine Kennzeichnung ist für Erzeugnisse erforderlich, die gleichwertig zu dem konventionellen Produkt sind, d.h. die keine stofflichen oder ernährungsphysiologischen Unterschiede zu den traditionellen Erzeugnissen aufweisen. Aus diesem Grunde ist auch für das nach der Novel Food VO zugelassene raffinierte Öle aus transgenem Raps, Mais oder Soja keine Kennzeichnung erforderlich. Ebenso werden Maisstärke und die daraus gewonnenen Erzeugnisse oder Kristallzucker aus transgenen Zuckerrüben als gleichwertig angesehen
Gerade im Kriterium der Gleichwertigkeit von Produkten sowie in der Ausnahme von Zusatzstoffen, Aromen und technischen Hilfsstoffen von der Kennzeichnung wurde von Verbrauchern, Kritiker der Gentechnik und Politikern einen Mangel der Novel Food VO. Sie sind der Ansicht, dass hierdurch viele Lebensmittel von der Kennzeichnungspflicht ausgenommen, Verbraucher nicht hinreichend über den Einsatz der Gentechnik informiert und ihnen gentechnisch modifizierte Lebensmittel heimlich untergeschoben werden.
In der Novel Food VO wird eine produkt- und verfahrensspezifische Kennzeichnung vorgeschrieben, aber mit Verabschiedung der Novel Food VO fehlten noch die Durchführungsbestimmungen, in denen Einzelheiten für die Etikettierung ausgeführt werden. Unklar war, wie gekennzeichnet, welcher Wortlaut für die Etikettierung gewählt werden muss und bis zu welcher Verarbeitungstiefe der Lebensmittel die Kennzeichnung greift.
Im Erwägungsgrund 10 der Novel Food VO wird darauf hingewiesen, dass auch eine Kennzeichnung derart erfolgen kann, dass das Lebensmittel oder die Zutat kein neuartiges Erzeugnis im Sinne der Verordnung darstellt. Eine Auslobung mit „gentechnikfrei“ bzw. „Ohne Gentechnik“ wären möglich. Allerdings fehlten auch hier entsprechenden Ausführungsbestimmungen.
Verordnung (EG) Nr. 1813/97 zur Etikettierungsrichtlinie 79/112/ EWG (Ergänzungsverordnung)
Noch vor Inkrafttreten der Novel Food VO erhielten herbizidtolerante Roundup Ready® Sojabohnen (RR-Sojabohnen) und insektenresistenter Bt-Mais (Bt-176) die Genehmigung zum Inverkehrbringen nach der Freisetzungsrichtlinie. In den
► Entscheidungen 96/281/EG
(Soja) und ► 97/98/EG
(Mais) wurde keine spezielle Kenntlichmachung der Produkte vorgeschrieben Da einerseits Soja- und Maisverarbeitungsprodukte in sehr vielen Lebensmitteln vorhanden sind und Verbraucher ein Anrecht auf Information über die Verwendung gentechnisch modifizierter Zutaten haben und anderseits Rechtsunsicherheiten und Wettbewerbsverzerrungen bei transgenen Folgevarietäten vermieden werden sollten, hat die Kommission die ► Etikettierungs-richtlinie 79/112/EWG
in dem Sinne ergänzt, dass die zugelassenen Soja- und Maisprodukte ab 1. November 1997 entsprechend Artikel 8 der Novel Food VO gekennzeichnet werden müssen. Zusatzstoffe (z.B. Sojalecithin) sind weiterhin von der Kennzeichnung ausgenommen, da sie nicht unter den Anwendungsbereich der Novel Food VO fallen.
Die ► Ergänzungsverordnung (EG) Nr. 1813/97
trat zwar zu diesem Zeitpunkt in Kraft. Da aber noch keine Ausführungsbestimmungen erlassen worden waren, brauchten die Erzeugnisse auch weiterhin nicht gekennzeichnet werden.
Für die dringend notwendigen Ausführungsbestimmungen legte die Kommission am 3. Dezember 1997 einen ergänzenden Vorschlag zur Etikettierung für Soja und Maisprodukte vor. Danach sollen Lebensmittel und Lebensmittelzutaten gekennzeichnet werden, wenn sie die neu eingeführte DNA (rDNA) oder Bruchstücke davon nachweisbar enthalten. Neu ist, dass die Erzeugnisse ebenfalls gekennzeichnet werden sollen, wenn sich in ihnen zwar keine rDNA, aber das (die) neu eingeführte(n) Protein(e) nachweisen lassen. In diesen Fällen sollen die Erzeugnisse deutlich mit „enthält bzw. hergestellt aus gentechnisch veränderte(n)m Soja / Mais“ kenntlich gemacht werden. Falls es nicht sicher ist, aber auch nicht völlig ausgeschlossen werden kann, dass Lebensmittel Zutaten aus den gentechnisch veränderten Pflanzen enthalten könnte, darf mit dem Hinweis „kann gentechnisch veränderte(s)n Soja / Mais enthalten“ gekennzeichnet werden. Diese „kann“-Bestimmung sollte vor allem für Soja- und Maisimporten, bei denen eine Mischung von konventionellen und transgenen Produkten nicht ausgeschlossen werden kann, gelten.
Verordnung (EG) 1139/98 zur Etikettierungsrichtlinie 79/112/EWG
(Ablöseverordnung)
Mit der Ergänzungsverordnung (EG) Nr.1813/97 waren weder die Kennzeichnungsterminologie noch das Vorgehen geregelt. Neue Ausführungen mussten baldmöglichst erlassen werden. Nach langwierigen Diskussionen zwischen den Mitgliedsstaaten hat der Agrarministerrat am 26. Mai 1998 die ► Verordnung (EG) Nr. 1139/98
erlassen, die die Nachweiskriterien, und den Wortlaut der Kennzeichnung sowie den Nachweis regelt (Tab. 17). Sie trat am 1. September 1998 in Kraft. Diese neue Verordnung (Ablöseverordnung) löst die Ergänzungsverordnung (EG) Nr. 1813/97 ab. Die Ablöseverordnung gilt nur für Erzeugnisse aus RR-Sojabohnen und Bt-Mais (Bt-176).
Zusatzstoffe werden von ihr nicht erfasst. Die Kennzeichnungspflicht umfasst unverpackte und lose Waren sowie Erzeugnisse der Gemeinschaftsverpflegung.
Lebensmittel oder Lebensmittelzutaten aus gv-Soja oder Mais müssen immer dann gekennzeichnet werden, wenn sich die neu eingeführte DNA oder das neu eingeführte Protein im Endprodukt, dem Produkt, das für den Verbraucher zum Verzehr bestimmt ist, nachweisen lässt. Diesen Fällen muss das Lebensmittel eine Kennzeichnung mit „aus genetisch veränderten Sojabohnen hergestellt“ bzw. „aus genetisch verändertem Mais hergestellt“ aufweisen. Die Kennzeichnung muss im Rahmen der Zutatenliste erfolgen; die Schriftgröße des Kennzeichnungstextes muss der Schriftgröße der Zutatenliste entsprechen.
Wenn keine der beiden Komponenten (rDNA bzw. neu eingeführtes Protein) nachgewiesen werden können, entfällt eine Kennzeichnungspflicht.
Die Verordnung enthält keine Ausführungen zu
• einem Schwellenwert,
• einer Negativliste,
• den Nachweisverfahren.
Verordnung (EG) Nr. 49/2000
In der Ablöseverordnung (EG) Nr. 1139/98 wurde die Einführung eines Schwellenwertes für die Menge an GVO-Bestandteilen (rDNA, Protein), der Kennzeichnungspflicht für Soja- und Maisprodukte auslösen soll, angekündigt. Mit der ► Verordnung (EG) Nr. 49/2000
wurde ein Schwellenwert von 1 % an neuem gentechnischen „Material“, bezogen auf eine einzelne Lebensmittelzutat oder ein einzelnes Lebensmittel aus/mit einer einzigen Zutat als zufällige, unbeabsichtigte oder technologisch unvermeidbare Beimischung mit GVO-Bestandteilen festgelegt.
Bei einer Beimischung mit GVO-Material im konventionellen Erzeugnis muss der Inverkehrbringer glaubhaft nachweisen, dass diese Bestandteile bis zu einem Prozent tatsächlich technologisch unvermeidbar waren bzw. zufällig und unbeabsichtigt in das Lebensmittelerzeugnis gelangt sind.
Der Schwellenwert von 1 % gilt auch für alle weiteren GVO-Produkte gelten, die entsprechend der Novel Food VO noch zugelassen werden.
Der Schwellenwert von 1% pro Zutat ist ein rein politischer Wert. Er hat keine wissenschaftliche Begründung. Aus wissenschaftlicher Sicht war der Schwellenwert von 1% viel zu niedrig angesetzt, denn die meisten europäischen Überwachungsbehörden konnten damals diesen Schwellenwert quantitativ kaum nachweisen. Dies drückt sich auch im Erwägungsgrund 8 mit „Es gibt bereits Nachweisverfahren - oder es wird diese in Kürze geben -, die es ermöglichen, diesen Wert einzuführen“ aus.
Verordnung (EG) Nr. 50/2000
Zusatzstoffe (z.B. Sojalecithin), Aromen und Extraktionsmittel werden von der Novel Food VO und der Ablöseverordnung nicht erfasst. Sie unterliegen somit auch keiner Kennzeichnung. Zur besseren Information der Verbraucher über Lebensmittel, die mit der Gentechnik in "Berührung" gekommen sind, hat - entsprechend einem Vorstoß von Österreich - die Kommission die ► Verordnung (EU) Nr. 50/2000
erlassen. Sie ergänzt die Etikettierungsrichtlinie 79/112/EWG sowie die Ablöseverordnung (EG) Nr. 1139/98. Die Kennzeichnungspflicht gilt für Zusatzstoffe (89/107/EWG) und Aromen (88/220/EWG), die GVO im Sinne der Freisetzungsrichtlinie 90/220/ EWG enthalten, aus GVO bestehen oder mit Hilfe von GVO hergestellt wurden. Enzyme, die nicht als Zusatzstoffe Anwendung finden, werden von der Verordnung nicht erfasst.
Sicherheitsbewertung - Prinzipien
Die Novel Food VO schreibt nicht nur eine Kennzeichnung neuartiger Lebensmittel vor, sondern – entsprechend dem Vorsorgeprinzip – auch eine Sicherheitsbewertung der Erzeugnisse (Art. 3). Die Novel Food VO ist auf die gesundheitliche Unbedenklichkeit der Erzeugnisse ausgerichtet. Umweltbelange werden durch die Freisetzungsrichtlinie 90/220/EWG geregelt.
Der Erstinverkehrbringer muss an Hand wissenschaftlicher Untersuchungen nachweisen, dass der Verzehr des neuen Produktes in üblichen Mengen und nach üblicher Zubereitung keine gesundheitliche Beeinträchtigung für den Verbraucher mit sich bringt. Die Sicherheitsbewertungen betreffen nicht nur gv-Lebensmittel (Gruppen 2a, b), sondern alle neuartigen Erzeugnisse (Gruppen 2c- 2f). Das Prinzip der substantiellen Äquivalenz in Verbindung mit den Verfahrensregeln seiner Anwendung bilden die Grundlage von Empfehlungen zur Sicherheitsbewertung von neuartigen Lebensmitteln im Rahmen der Novel Food VO.
Empfehlungen des Wissenschaftlichen Lebensmittelausschusses
Noch vor Inkrafttreten der Novel Food VO wurden die Empfehlungen zur Erstellung von Anträgen und Erstprüfungen sowie zu den wissenschaftlichen Anforderungen an Sicherheitsbewertungen von Lebensmitteln und Lebensmittelzutaten durch den Wissenschaftlichen Lebensmittelausschuss erarbeitet (Art. 4; Art.11). Diese ► Empfehlungen 97/618/EG
geben an
- welche Informationen für die Befürwortung von Anträgen auf das Inverkehrbringen neuartiger Lebensmittel und Lebensmittelzutaten erforderlich sind,
- wie diese Informationen darzulegen sind,
- was die Berichtszusammenstellung über die Erstprüfung von Anträgen auf Genehmigung des Inverkehrbringens neuartiger Lebensmittel und Lebensmittelzutaten enthalten müssen.
Die Empfehlungen sollen
- Antragstellern und Prüfbehörden helfen, die formalen und wissenschaftlichen Anforderungen, die an Anträge und Erstprüfberichte gestellt werden, zu erfüllen und
- Umfang der, und wissenschaftliche Anforderungen an die Sicherheitsbewertung aufzeigen.
Ziel der Empfehlungen ist eine Harmonisierung der formalen und wissenschaftlichen Bewertung der Anträge sowie des Umfangs und den Anforderungen an die Untersuchungen zur Sicherheit der Lebensmittel und Lebensmittelzutaten in der EU.
Für die Durchführbarkeit der Sicherheitsbewertung teilt der Wissenschaftliche Lebensmittelausschuss die Erzeugnisse in sechs Kategorien (ein und stellt sie zu den Gruppen der unter die Novel Food VO der fallenden Erzeugnisse (Art.1, (2) in Beziehung. Für das Inverkehrbringen müssen die Erzeugnisse die Anforderungen des Artikel 3, (1) (Gesundheitsschutz, keine Irreführung, keine Ernährungsmängel) erfüllen. Damit sie diesen nach der Bewertung genügen, wurde für jede Kategorie eine Reihe von Prüfkriterien aufgestellt. Zu diesen 13 Prüfpunkten erarbeitete der Wissenschaftliche Lebensmittelausschuss jeweils einen Fragenkatalog (keinen Entscheidungsbaum!), der eine umfassende Sicherheitsbewertung ermöglicht.
Art und Umfang der Sicherheitsprüfungen hängen weitgehend von der Klassifizierung der Lebensmittel ab. Für den Bereich der Gentechnik sind es die Klassen der
• gentechnisch veränderten Tiere und aus solchen hergestellten Erzeugnissen,
• gentechnisch veränderten Pflanzen und aus solchen Erzeugnissen
• gentechnisch veränderten Mikroorganismen und aus solchen hergestellten Erzeugnissen.
Die zur Bewertung der gesundheitlichen Unbedenklichkeit erforderlichen Untersuchungen bzw. Daten sind nach 13 Prüfpunkten gegliedert. Anhand von strukturierten Fragen (kann der Erstinverkehrbringer überprüfen, ob der Umfang seiner Sicherheitsanalysen hinreichend für die Bewertung der gesundheitlichen Unbedenklichkeit ist oder nicht.
Die Stellungnahme des Wissenschaftlichen Lebensmittelausschusses hat zwar nur empfehlenden Charakter. Aber alle Erstprüfbehörden der EU-Mitgliedsstaaten sowie Erstinverkehrbringer folgen diesen Empfehlungen. Die Erstprüfberichte der nationalen Behörden stehen allen EU-Mitgliedsstaaten zur Verfügung; sie können zu den Ergebnissen der Bewertung Stellung beziehen und gegen das Bewertungsergebnis Einspruch einlegen. Mit dem Einspruch eines Mitgliedstaates unterliegt das gentechnisch modifizierte Lebensmittel automatisch dem Genehmigungsverfahren der Europäischen Kommission. Durch die Art und Weise des Zulassungsverfahrens gewährleistet weitgehend eine unabhängige Bewertung der vorgelegten Daten. Kein EU-Mitgliedsstaat kann in einer Einzelentscheidung ein gentechnisch modifiziertes Lebensmittel für den freien Verkehr zulassen. Stets sind alle Prüfbehörden der Mitgliedsstaaten und die EU-Kommission beteiligt. Objektivität und Unabhängigkeit der staatlichen Kontrollbehörden sind gewährleistet. Auch der entsprechende Umfang der Sicherheitsanalysen zur Bewertung der gesundheitlichen Unbedenklichkeit ist gegeben, wobei der Erstinverkehrbringer zunächst einen gewissen Spielraum zu haben scheint. Jedoch werden ihn die nationalen Kontrollbehörden schnell und eindeutig auf unzureichende oder fehlende Daten hinweisen und ihn auffordern, diese noch zu erheben.
► Richtlinie 2000/13/EG
hat keinen unmittelbaren Bezug zur Gentechnik. Mit ihr sollen die allgemeinen Rechtsvorschriften der Mitgliedssaaten zur Kennzeichnung und Aufmachung von Lebensmitteln angeglichen werden.
Mit der ► VO (EG) Nr. 1852/2001
wird festgelegt, welche Informationen aus der Antragsstellung an die Öffentlichkeit weitergegeben und welche zum Schutz des Antragstellers als vertraulich eingestuft werden dürfen. Angaben, die für die Sicherheitsbewertung essentiell sind, können nicht als vertraulich eingestuft werden.
Die Novel Food VO verlor im April 2004 mit in Kraft treten der Gen-Food-Verordnungen ihre Gültigkeit in Bezug auf Gentechnik und Lebensmittel. In der neuen Novel Food VO (► konsolidierte Fassung) sind Lebensmittel aus der Gentechnik keine neuartigen Lebensmittel mehr. Sie werden separt in den Gen-Food-Verordnungen reguliert.
Die gegenwärtig gültige ► Novel Food VO
wurde im November 2015 erlassen.
Regularien:
Verordnungen:
► Verordnung (EG) Nr. 258/97 des Europäischen Parlaments und des Rates vom 27. Januar 1997 über neuartige Lebensmittel und neuartige
Lebensmittelzutaten. Abl. L 43, 1-6 vom 14.02.1997
► Verordnung (EG) Nr. 1813/97 der Kommission vom 19. September 1997 über Angaben, die zusätzlich zu den in der Richtlinie 79/112/EWG des
Rates aufgeführten Angaben auf dem Etikett bestimmter aus genetisch veränderten Organismen hergestellter Lebensmittel vorgeschrieben sind. ABl L. 257, 7-8 vom 20.09.1997
► Verordnung (EG) Nr. 49/2000 der Kommission vom 10. Januar 2000 zur Änderung der Verordnung (EG) Nr. 1139/98 des Rates über Angaben, die
zusätzlich zu den in der Richtlinie 79/112/EWG aufgeführten Angaben bei der Etikettierung bestimmter aus genetisch veränderten Organismen hergestellter Lebensmittel vorgeschrieben sind.
► Verordnung (EG) Nr. 50/2000 der Kommission vom 10. Januar 2000 über die Etikettierung von Lebensmitteln und Lebensmittelzutaten, die
genetisch veränderte oder aus genetisch veränderten Organismen hergestellte Zusatzstoffe und Aromen enthalten.
► Verordnung (EG) Nr. 258/97 des Europäischen Parlaments und des Rates vom 27. Januar 1997 über neuartige Lebensmittel und neuartige
Lebensmittelzutaten (Konsolidierte Fassung)
►Verordnung (EG) Nr. 1852/2001 der Kommission vom 20. September 2001 mit Durchführungsbestimmungen gemäß der Verordnung (EG)
Nr. 258/97 des Europäischen Parlaments und des Rates für die Information der Öffentlichkeit und zum Schutz der übermittelten Informationen
► Verordnung (EU) 2015/2283 des Europäischen Parlaments und des Rates vom 25. November 2015 über neuartige Lebensmittel, zur Änderung der
Verordnung (EU) Nr. 1169/2011 des Europäischen Parlaments und des Rates und zur Aufhebung der Verordnung (EG) Nr. 258/97 des Europäischen Parlaments und des Rates und der Verordnung (EG) Nr. 1852/2001 der Kommission ABl L 327, 1 – 22 vom 11.12.2015
Richtlinien:
► Richtlinie 79/112/EWG des Rates vom 18. Dezember 1978 zur Angleichung der Rechtsvorschriften der Mitgliedstaaten über die Etikettierung
und Aufmachung von für den Endverbraucher bestimmten Lebensmitteln sowie die Werbung hierfür. Abl L 33, 1-14 vom 08.02.1997
► Richtlinie 88/344/EWG des Rates vom 13. Juni 1988 zur Angleichung der Rechtsvorschriften der Mitgliedstaaten über Extraktionslösungsmittel,
die bei der Herstellung von Lebensmitteln und Lebensmittelzutaten verwendet werden. ABl L 157, 28-33 vom 24.06.1988
► Richtlinie 88/388/EWG des Rates vom 22. Juni 1988 zur Angleichung der Rechtsvorschriften der Mitgliedstaaten über Aromen zur Verwendung in
Lebensmitteln und über Ausgangsstoffe für ihre Herstellung. ABl L 184, 61-66 vom 15.07.1988
► Richtlinie 89/107/EWG des Rates vom 21. Dezember 1988 zur Angleichung der Rechtsvorschriften der Mitgliedstaaten über Zusatzstoffe, die in
Lebensmitteln verwendet werden dürfen. ABl L 40, 27-33 vom 11.02.1989
► Richtlinie 2000/13/EG des Europäischen Parlaments und des Rates vom 20. März 2000 zur Angleichung der Rechtsvorschriften der Mitgliedstaaten
über die Etikettierung und Aufmachung von Lebensmitteln sowie die Werbung hierfür. ABl L 109, 29-42 vom 06.05.2000
Entscheidungen / Empfehlungen:
► 96/281/EG: Entscheidung der Kommission vom 3. April 1996 über das Inverkehrbringen genetisch veränderter Sojabohnen (Glycin max. L.) mit
erhöhter Verträglichkeit des Herbizids Glyphosat nach der Richtlinie 90/220/EWG des Rates. ABl L 107, 10-11 vom 30.04.1996
► 97/98/EG: Entscheidung der Kommission vom 23. Januar 1997 über das Inverkehrbringen von genetisch verändertem Mais (Zea Mays L.) mit der
kombinierten Veränderung der Insektizidwirkung des BT-Endotoxin-Gens und erhöhter Toleranz gegenüber dem Herbizid Glufosinatammonium gemäß der Richtlinie 90/220/EWG des Rates. ABl L 31, 69-70 vom 01.02.1997
► 97/618/EG: Empfehlung der Kommission vom 29. Juli 1997 zu den wissenschaftlichen Aspekten und zur Darbietung der für Anträge auf
Genehmigung des Inverkehrbringens neuartiger Lebensmittel und Lebensmittelzutaten erforderlichen Informationen sowie zur Erstellung der Berichte über die Erstprüfung gemäß der Verordnung (EG) Nr. 258/97 des Europäischen Parlamentes und des Rates (97/618/EG).ABl L 253/1: 16.9.1997.
► 98/294/EWG: Entscheidung der Kommission vom 22. April 1998 über das Inverkehrbringen von genetisch verändertem Mais (Zea mays L.,
Linie MON 810) gemäß der Richtlinie 90/220/EWG des Rates ABl L 131, 32-33 vom 05.05.1998
Ohne unmittelbaren Bezug auf die Novel Food VO:
► Richtlinie 90/220/EWG des Rates vom 23. April 1990 über die absichtliche Freisetzung genetisch veränderter Organismen in die Umwelt.
ABl. L 117, 15 - 27 vom 08.05.1999
► Verordnung (EG) Nr. 1829/2003 des Europäischen Parlaments und des Rates vom 22. September 2003 über genetisch veränderte Lebensmittel
und Futtermittel. ABl. L. 268, 1-23 vom 18.10.2003
► Verordnung (EG) Nr. 1830/2003 des Europäischen Parlaments und des Rates vom 22. September 2003 über die Rückverfolgbarkeit und
Kennzeichnung von genetisch veränderten Organismen und über die Rückverfolgbarkeit von aus genetisch veränderten Organismen hergestellten Lebensmitteln und Futtermitteln sowie zur Änderung der Richtlinie 2001/18/EG. ABl. L. 268, 24-28 vom 18.10.2003